細胞培養進口血清進口胎牛血清進口新生牛血清進口豬血清馬血清
細胞培養進口血清進口胎牛血清進口新生牛血清進口豬血清馬血清 支原體檢測盒及標準品常規PCR檢測試劑盒熒光定量PCR檢測(qPCR法)支原體DNA提取靈敏度標準品(方法驗證用)特異性標準品(方法驗證用)PCR定量標準品(可用于方法驗證)
支原體檢測盒及標準品常規PCR檢測試劑盒熒光定量PCR檢測(qPCR法)支原體DNA提取靈敏度標準品(方法驗證用)特異性標準品(方法驗證用)PCR定量標準品(可用于方法驗證) 支原體祛除試劑細胞中支原體祛除環境支原體祛除水槽支原體祛除
支原體祛除試劑細胞中支原體祛除環境支原體祛除水槽支原體祛除 干細胞培養基
干細胞培養基 DNA/RNA污染祛除DNA/RNA污染祛除試劑DNA污染監測
DNA/RNA污染祛除DNA/RNA污染祛除試劑DNA污染監測 RNA病毒研究試劑RNA病毒檢測試劑盒病毒RNA提取
RNA病毒研究試劑RNA病毒檢測試劑盒病毒RNA提取 PCR儀器及配套產品DNA污染監測祛除PCR/qPCR儀性能檢查PCR試劑PCR試劑盒PCR預混液(凍干粉)熱啟動聚合酶MB Taq DNA
PCR儀器及配套產品DNA污染監測祛除PCR/qPCR儀性能檢查PCR試劑PCR試劑盒PCR預混液(凍干粉)熱啟動聚合酶MB Taq DNA 微生物PCR檢測食品檢測類產品食品微生物檢測細菌PCR檢測
微生物PCR檢測食品檢測類產品食品微生物檢測細菌PCR檢測
- 細胞培養進口血清進口胎牛血清進口新生牛血清進口豬血清馬血清
- 支原體檢測盒及標準品常規PCR檢測試劑盒熒光定量PCR檢測(qPCR法)支原體DNA提取靈敏度標準品(方法驗證用)特異性標準品(方法驗證用)PCR定量標準品(可用于方法驗證)
- 支原體祛除試劑細胞中支原體祛除環境支原體祛除水槽支原體祛除
- 干細胞培養基
- DNA/RNA污染祛除DNA/RNA污染祛除試劑DNA污染監測
- RNA病毒研究試劑RNA病毒檢測試劑盒病毒RNA提取
- PCR儀器及配套產品DNA污染監測祛除PCR/qPCR儀性能檢查PCR試劑PCR試劑盒PCR預混液(凍干粉)熱啟動聚合酶MB Taq DNA
- 微生物PCR檢測食品檢測類產品食品微生物檢測細菌PCR檢測
|
|
總局發布《疫苗儲存和運輸管理規范(2017年版)》,即日起實施2018-01-08 14:23
各省、自治區、直轄市衛生計生委、食品藥品監督管理局,新疆生產建設兵團衛生局、食品藥品監督管理局,中國疾病預防控制中心:
為加強疫苗儲存和運輸管理工作,根據修訂后的《疫苗流通和預防接種管理條例》和《關于進一步加強疫苗流通和預防接種管理工作的意見》(國辦發〔2017〕5號),國家衛生計生委、食品藥品監管總局對《疫苗儲存和運輸管理規范》(衛疾控發〔2006〕104號)進行了修訂,形成了《疫苗儲存和運輸管理規范(2017年版)》(可從國家衛生計生委網站http://www.nhfpc.gov.cn下載)。現印發給你們,請遵照執行。
國家衛生計生委 食品藥品監管總局
疫苗儲存和運輸管理規范(2017年版)
**章 總 則
**條 為規范疫苗儲存、運輸,加強疫苗質量管理,保障預防接種的安全性和有效性,根據《疫苗流通和預防接種管理條例》,制定本規范。
第二條 本規范適用于疾病預防控制機構、接種單位、疫苗生產企業、疫苗配送企業、疫苗倉儲企業的疫苗儲存、運輸管理。疾病預防控制機構、接種單位的疫苗儲存、運輸管理還應當遵守《預防接種工作規范》;疫苗生產企業、疫苗配送企業、疫苗倉儲企業的疫苗儲存、運輸管理還應當遵守《藥品經營質量管理規范》。
第三條 疫苗生產企業、疫苗配送企業、疫苗倉儲企業應當配備從事疫苗管理的專職人員,疾病預防控制機構、接種單位應當有專(兼)職人員負責疫苗管理,并接受相關業務培訓。疾病預防控制機構、接種單位、疫苗生產企業、疫苗配送企業、疫苗倉儲企業應當建立疫苗儲存、運輸管理制度,做好疫苗的儲存、運輸工作。
第四條 各級衛生計生行政部門和食品藥品監督管理部門負責本規范實施的監督管理工作。
第二章 疫苗儲存、運輸的設施設備
第五條 疾病預防控制機構、接種單位、疫苗生產企業、疫苗配送企業、疫苗倉儲企業應當裝備保障疫苗質量的儲存、運輸冷鏈設施設備。
(一)省級疾病預防控制機構、疫苗生產企業、疫苗配送企業、疫苗倉儲企業應當根據疫苗儲存、運輸的需要,配備普通冷庫、低溫冷庫、冷藏車和自動溫度監測器材或設備等。
(二)設區的市級、縣級疾病預防控制機構應當配備普通冷庫、冷藏車或疫苗運輸車、低溫冰箱、普通冰箱、冷藏箱(包)、冰排和溫度監測器材或設備等。
(三)接種單位應當配備普通冰箱、冷藏箱(包)、冰排和溫度監測器材或設備等。
第六條 疾病預防控制機構、接種單位的疫苗儲存、運輸設施設備管理和維護要求:
(一)用于疫苗儲存的冷庫容積應當與儲存需求相適應,應當配有自動監測、調控、顯示、記錄溫度狀況以及報警的設備,備用制冷機組、備用發電機組或安裝雙路電路。
(二)冷藏車能自動調控、顯示和記錄溫度狀況。
(三)冰箱的補充、更新應當選用具備醫療器械注冊證的醫用冰箱。
(四)冷藏車、冰箱、冷藏箱(包)在儲存、運輸疫苗前應當達到相應的溫度要求。
(五)自動溫度監測設備,溫度測量精度要求在±0.5℃范圍內;冰箱監測用溫度計,溫度測量精度要求在±1℃范圍內。
第七條 有條件的地區或單位應當建立自動溫度監測系統。自動溫度監測系統的測量范圍、精度、誤差等技術參數能夠滿足疫苗儲存、運輸管理需要,具有不間斷監測、連續記錄、數據存儲、顯示及報警功能。
第八條 疾病預防控制機構、接種單位、疫苗生產企業、疫苗配送企業、疫苗倉儲企業應當建立健全冷鏈設備檔案,并對疫苗儲存、運輸設施設備運行狀況進行記錄。
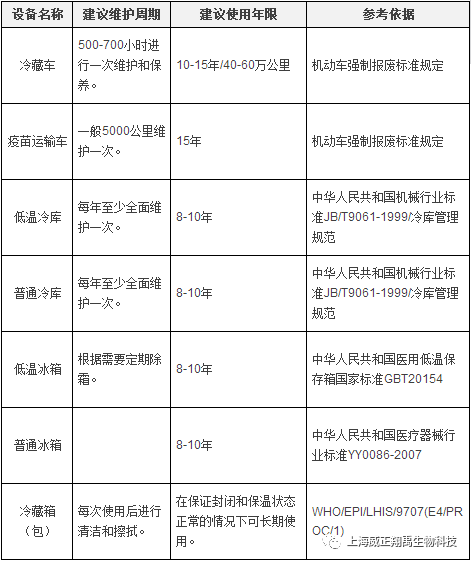
第九條 疾病預防控制機構應當定期評估轄區內冷鏈設施設備的裝備和運行狀況,根據預防接種工作需要,制定冷鏈設備補充、更新需求計劃,參考“冷鏈設備維護周期和使用年限參考標準”(附件1),報同級衛生計生行政部門和上級疾病預防控制機構,及時補充、更新冷鏈設備設施。
第三章 疫苗儲存、運輸的溫度監測
第十條 疾病預防控制機構、接種單位、疫苗生產企業、疫苗配送企業、疫苗倉儲企業必須按照疫苗使用說明書、《預防接種工作規范》等有關疫苗儲存、運輸的溫度要求儲存和運輸疫苗。
第十一條 疾病預防控制機構、接種單位應當按以下要求對疫苗的儲存溫度進行監測和記錄。
(一)采用自動溫度監測器材或設備對冷庫進行溫度監測,須同時每天上午和下午至少各進行一次人工溫度記錄(間隔不少于6小時),填寫“冷鏈設備溫度記錄表”(附件2)。
(二)采用溫度計對冰箱(包括普通冰箱、低溫冰箱)進行溫度監測,須每天上午和下午各進行一次溫度記錄(間隔不少于6小時),填寫“冷鏈設備溫度記錄表”(附件2)。溫度計應當分別放置在普通冰箱冷藏室及冷凍室的中間位置,低溫冰箱的中間位置。每次應當測量冰箱內存放疫苗的各室溫度,冰箱冷藏室溫度應當控制在2℃~8℃,冷凍室溫度應當控制在≤-15℃。有條件的地區或單位可以應用自動溫度監測器材或設備對冰箱進行溫度監測記錄。
(三)可采用溫度計對冷藏箱(包)進行溫度監測,有條件的地區或單位可以使用具有外部顯示溫度功能的冷藏箱(包)。
第十二條 疫苗配送企業、疾病預防控制機構、接種單位應當對疫苗運輸過程進行溫度監測,并填寫“疫苗運輸溫度記錄表”(附件3)。
(一)記錄內容包括疫苗運輸工具、疫苗冷藏方式、疫苗名稱、生產企業、規格、批號、有效期、數量、用途、啟運和到達時間、啟運和到達時的疫苗儲存溫度和環境溫度、啟運至到達行駛里程、送/收疫苗單位、送/收疫苗人簽名。
(二)運輸時間超過6小時,須記錄途中溫度。途中溫度記錄時間間隔不超過6小時。
第十三條 對于冷鏈運輸時間長、需要配送至偏遠地區的疫苗,省級疾病預防控制機構應當對疫苗生產企業提出加貼溫度控制標簽的要求并在招標文件中提出。疫苗生產企業應當根據疫苗的穩定性選用合適規格的溫度控制標簽。
第十四條 疫苗儲存、運輸過程中的溫度記錄可以為紙質或可識讀的電子格式,溫度記錄要求保存至超過疫苗有效期2年備查。
第四章 疫苗儲存、運輸中的管理
第十五條 疫苗生產企業、疫苗配送企業、疾病預防控制機構在供應或分發疫苗時,應當向收貨方提供疫苗運輸的設備類型、起運和到達時間、本次運輸過程的疫苗運輸溫度記錄、發貨單和簽收單等資料。
第十六條 疾病預防控制機構、接種單位在接收或者購進疫苗時,應當索取和檢查疫苗生產企業或疫苗配送企業提供的《生物制品批簽發合格證》復印件,進口疫苗還應當提供《進口藥品通關單》復印件。收貨時應當核實疫苗運輸的設備類型、本次運輸過程的疫苗運輸溫度記錄,對疫苗運輸工具、疫苗冷藏方式、疫苗名稱、生產企業、規格、批號、有效期、數量、用途、啟運和到達時間、啟運和到達時的疫苗儲存溫度和環境溫度等內容進行核實并做好記錄。
(一)對于資料齊全、符合冷鏈運輸溫度要求的疫苗,方可接收。
(二)對資料不全、符合冷鏈運輸溫度要求的疫苗,接收單位可暫存該疫苗。待補充資料,符合**款要求后辦理接收入庫手續。
(三)對不能提供本次運輸過程的疫苗運輸溫度記錄或不符合冷鏈運輸溫度要求的疫苗,不得接收或購進。疫苗儲存、運輸過程中溫度異常的處理,按照第二十二、二十三、二十四條執行。
第十七條 疾病預防控制機構、接種單位對驗收合格的疫苗,應當按照規定的溫度要求儲存,按疫苗品種、批號分類碼放。
第十八條 疾病預防控制機構、接種單位應當按照有效期或進貨先后順序供應、分發和使用疫苗。
第十九條 疫苗生產企業、疫苗配送企業、疫苗倉儲企業應當定期對儲存的疫苗進行檢查并記錄。對超過有效期或儲存溫度不符合要求的疫苗,應當采取隔離存放、暫停發貨等措施。
第二十條 疾病預防控制機構、接種單位應當定期對儲存的疫苗進行檢查并記錄,對包裝無法識別、超過有效期、不符合儲存溫度要求的疫苗,應當定期逐級上報,其中**類疫苗上報至省級疾病預防控制機構,第二類疫苗上報至縣級疾病預防控制機構。
對于需報廢的疫苗,應當在當地食品藥品監督管理部門和衛生計生行政部門的監督下,按照相關規定統一銷毀。接種單位需報廢的疫苗,應當統一回收至縣級疾病預防控制機構統一銷毀。疾病預防控制機構、接種單位應當如實記錄銷毀、回收情況,銷毀記錄保存5年以上。
第二十一條 疫苗的收貨、驗收、在庫檢查等記錄應當保存至超過疫苗有效期2年備查。
第五章 疫苗儲存、運輸中溫度異常的管理
第二十二條 疫苗應當在批準的溫度范圍(控制溫度)內儲存、運輸。疫苗生產企業應當評估疫苗儲存、運輸過程中出入庫、裝卸等常規操作產生的溫度偏差對疫苗質量的影響及可接收的條件。符合接收條件的,疫苗配送企業、疾病預防控制機構、接種單位應當接收疫苗。
第二十三條 疾病預防控制機構、接種單位采用冰箱、冷藏箱(包)儲存疫苗的,在存放、取用疫苗時應當及時開關冰箱、冷藏箱(包)門/蓋,盡可能減少疫苗暴露于控制溫度范圍外的時間。
第二十四條 在特殊情況下,如停電、儲存運輸設備發生故障,造成溫度異常的,須填寫“疫苗儲存和運輸溫度異常情況記錄表”(附件4)。疫苗生產企業應當及時啟動重大偏差或次要偏差處理流程,評估其對產品質量的潛在影響,并將評估報告提交給相應單位。經評估對產品質量沒有影響的,可繼續使用。經評估對產品質量產生不良影響的,應當在當地衛生計生行政部門和食品藥品監督管理部門的監督下銷毀。
第六章 附 則
第二十五條 本規范由國家衛生計生委和國家食品藥品監督管理總局負責解釋。
第二十六條 本規范自發布之日起施行。
附件1 冷鏈設備維護周期和使用年限參考標準
下一篇: 下肢骨細胞竟然可以通過感受體重變化
|
 細胞培養進口血清
細胞培養進口血清 支原體祛除試劑
支原體祛除試劑 干細胞培養基
干細胞培養基